Gastrulatie
| Gastrulatie | ||||
|---|---|---|---|---|
 | ||||
Gastrulatie vindt plaats als een blastula, bestaande uit één laag, zich naar binnen vouwt en groeit om een gastrula te vormen. Kleurcode bij deze afbeelding: ectoderm, blauw; endoderm, groen; blastocoel (dooierzak), geel; en archenteron (oerdarm), paars. (Afbeelding: Abigail Pyne) | ||||
| Gegevens | ||||
| Embryologie | Embryogenese, 4e fase | |||
| Naslagwerken | ||||
| MeSH | 054262 | |||
| ||||


Gastrulatie is een fase in de vroege embryonale ontwikkeling van de meeste dieren. In deze fase wordt de enkellaagse blastula gereorganiseerd tot een meerlagige structuur die de gastrula wordt genoemd. Bij de mens begint de vorming van de gastrula als het embryo twee weken oud is en eindigt als deze vier weken oud is. Vóór de gastrulatie is het embryo een kiemblad (een epitheelblad van cellen); tegen het einde van de gastrulatie is het embryo begonnen met differentiatie waarbij verschillende cellijnen worden bepaald, de basisassen van het lichaam op te zetten (bijv. dorsaal-ventraal, anterior-posterior) en één of meer celtypen te internaliseren, inclusief de toekomstige darm.
In triploblastische dieren, waartoe ook de mens behoort, is de gastrula trilaminair ("drielaags"). Deze drie kiemlagen zijn het ectoderm, mesoderm en endoderm.[1][2] In diploblastische organismen, zoals neteldieren (Cnidaria) en ribkwallen (Ctenophora), bestaat de gastrula alleen uit ectoderm en endoderm. Die twee lagen worden soms ook aangeduid als hypoblast en epiblast.[3]
De namen "gastrula" en "gastrulatie" werden door Ernst Haeckel geïntroduceerd, in zijn boek Biology of Calcareous Sponges (1872).[4][5]
Vorming van de gastrula
Celstratificatie

(afbeelding vervaardigd door Zephyris)

Gastrulatie vindt plaats na celklieving en de vorming van de blastula. Gastrulatie wordt gevolgd door neurulatie en organogenese, waarin zich individuele organen ontwikkelen binnen de nieuw gevormde kiemlagen.[6] Uit elke laag ontstaan later specifieke weefsels en organen.
Uit het ectoderm komen de epidermis (vergelijk dermis) en het zenuwstelsel voort, en in gewervelden ook de 'neurale top' (crista neuralis). Uit het endoderm ontspringen het epitheel van het spijsverteringsstelsel en van het ademhalingssysteem, alsook de organen die betrokken zijn spijsverteringsstelsel, zoals de lever en de alvleesklier.
Het mesoderm is de basis van diverse celtypen, zoals spieren, botten en bindweefsel. In gewervelden ontwikkelen mesodermderivaten[7] zich tot de chorda dorsalis, het hart, bloed en bloedvaten, het kraakbeen van de ribben en wervels, en de dermis.[8] Na de gastrulatie worden de cellen in het embryo georganiseerd in bladen van verbonden cellen, zoals in epithelia, of als een mazig netwerk van geïsoleerde cellen, zoals het mesenchym.[2][9]
Moleculair mechanisme



Het moleculaire mechanisme en de timing van gastrulatie verschillen per organisme.
Gemeenschappelijke kenmerken van gastrulatie in triploblastische organismen zijn:
- een verandering van de topologische structuur van het embryo, van een enkelvoudig samenhangend oppervlak (bol-achtige) tot een niet-enkelvoudig samenhangend oppervlak (torus-achtig);
- de differentiatie van cellen naar een van de drie typen (endodermaal, mesodermaal en ectodermaal);
- de spijsverteringsfunctie van een groot aantal endodermale cellen.
De signaleringstrajecten, signalen die een proces in het organisme activeren of remmen, verschillen ook per organisme.


Hoewel gastrulatiepatronen binnen het dierenrijk een enorme variatie vertonen, worden zij allen gekenmerkt door de vijf basistypen van celbewegingen[10] die optreden tijdens de gastrulatie:
- invaginatie; een instulping van het beoogde endoderm in het binnenste van de met vocht gevulde holte (blastocoel) van de blastula: door vervorming van cellen aan een pool van de blastula wordt een deel van de buitenwand ingestulpt; het resultaat ziet er uit als een lekke voetbal die aan een kant is ingedrukt. Het gedeelte dat aan de binnenkant ligt, wordt vanaf dat moment met de term endoderm aangeduid. De binnenste holte van de blastula, de primaire levensholte, wordt bij deze gebeurtenis ingesnoerd; deze uit endoderm bestaande deuk wordt met oerdarm of archenteron aangeduid.
- involutie;
- ingressie, immigreren van cellen van het toekomstige endoderm;
- delaminatie;
- epibolie, is in principe een invaginatie en epibolische verplaatsing houdt in: de manier waarop een laag epitheelcellen zich verspreidt, zo kan het toekomstige ectoderm - bijvoorbeeld - het endoderm ‘overgroeien’.
Protostomia versus Deuterostomia
Het onderscheid tussen Protostomia en Deuterostomia is gebaseerd op de richting waarin de mond (stoma) zich ontwikkelt ten opzichte van de blastopore (zie ook blastocyste). Protostome is afgeleid van het Griekse woord protostoma dat "eerste mond" betekent (πρώτος + στόμα), terwijl de etymologie van deuterostome "tweede mond" is (δεύτερος + στόμα).
Het belangrijkste onderscheid tussen Deuterostomia en Protostomia valt dus waar te nemen tijdens de embryonale ontwikkeling en betreft:
- Mond/anus
- In de ontwikkeling van Protostomia wordt de opening die zich het eerst ontwikkelt, de blastopore, de mond van het dier.
- Bij deuterostome ontwikkeling wordt de blastopore uiteindelijk de anus.
- Klieving
- In Protostomia is spiraalvormige splitsing bepalend, wat inhoudt dat de specialisatie van de cellen wordt bepaald terwijl zij worden gevormd.
- Deuterostomia kennen radiale splitsing en die is onbepaald.
Klassieke modelsystemen voor het begrijpen van gastrulatie

Ondanks de genoemde variatie in gastrulatiepatronen heeft men veel overeenkomsten ontdekt en gemodelleerd. Het makkelijkst valt de ontwikkeling te bestuderen bij dieren die zich buiten de moeder ontwikkelen.
Dieren waarvan de gastrulatie tot in de kleinste details wordt begrepen, zijn weekdieren, zee-egels, kikkers en kippen. Hieronder zullen enkele van deze details voor de genoemde dierlijke modellen worden uitgewerkt, weliswaar op taxonomisch verschillend niveau.
Zee-egels
Zee-egels, Euechinoidea, zijn sinds de 19e eeuw vaak als een belangrijk model in de ontwikkelingsbiologie gebruikt.[11] Hun gastrulatie wordt beschouwd als het archetype voor ongewervelde deuterostomia.[12]
Bepaling van de kiemlaag
Zee-egels vertonen zeer stereotiepe klievingspatronen en celspecialisatie. Maternaal afgezet, divers mRNA verzorgt de aanmaak van een soort organisatiecentrum in het zee-egelembryo. Biologisch gezaghebbende signalering van Wnt en Delta-Notch zorgen voortdurend voor het scheiden van het progressief endoderm en mesoderm.[13]
Celinternalisatie
Bij zee-egels maken de primaire mesenchymcellen zich los van de vegetatieve pool, veranderen van vorm en gaan de met vloeistof gevulde holte (blastocoel) in het midden binnen. Zij hebben een skeletogene voorbestemming en schuiven epibolisch tijdens het blastula stadium naar binnen.
Gastrulatie begint met instulping en andere celherschikkingen van de vegetatieve pool, die ongeveer 30% bijdraagt aan de uiteindelijke lengte van het archenteron (oerdarm). De uiteindelijke lengte van de darm[14] hangt af van de reorganisatie binnen het archenteron.[15][16]
Amfibieën
Kikkers (staartloze amfibieën, Anura) zijn eveneens een klassiek modelsysteem voor gastrulatie. Met amfibieën is het proces van embryonale inductie intensief bestudeerd; het proces waarbij biochemische en mechanische signalen celmigratie en -differentiatie induceren.
Symmetrie verbreken
De spermacel levert een van de twee mitotische spoelfiguren die nodig zijn om de eerste splitsing te voltooien. De andere is in de eicel zelf aanwezig. Het exacte punt waar de spermacel de eicel binnenkomt, zal daarmee de radiale symmetrie van de eicel doorbreken door het cytoskelet te re-organiseren tijdens de zygotevorming. Voorafgaand aan de eerste splitsing roteert de cortex van de eicel ten opzichte van het (interne) cytoplasma door de gecoördineerde samenwerking van microtubuli. Dit proces wordt corticale rotatie genoemd. Deze verplaatsing brengt maternaal geladen determinanten, die de bestemming van de cel van het equatoriale cytoplasma en de vegetatieve cortex bepalen, met elkaar in contact. Samen construeren deze determinanten de zogenaamde organisator. Het gebied aan de vegetatieve kant, tegenover het ingangspunt van de spermacel, zal zodoende deze organisator worden.[17] Van deze speciale organisator in het embryo is aangetoond dat zij zowel noodzakelijk als voldoende is om gastrulatie te induceren.[18][19][20]
Bepaling van de kiemlaag
Specificatie binnen het endoderm hangt af van de herschikking van maternaal afgezette determinanten, leidend tot nuclearisatie van beta-catenine. Mesodermvorming wordt geïnduceerd door seinen vanuit het endoderm naar cellen die anders ectoderm zouden worden.[17]
Celinternalisatie
De dorsale lip van de blastopore is de mechanische schakelaar van de gastrulatie. Het eerste teken van invaginatie in de gastrulatie in de kikker is de dorsale lip.
Celsignalering
In de kikker, Xenopus, is een van de signalen retinezuur (RA).[21] RA-signalering in dit organisme kan de vorming van het endoderm beïnvloeden en kan - afhankelijk van de timing van de signalering - bepalen of cellen zich ontwikkelen tot alvleesklier-, darm- of respiratoir weefsel. Bij laatstgenoemde spelen ook andere signalen een rol, zoals gedurende de signaaltransductie Wnt en het botmorfogenetisch eiwit BMP, door het activeren van cellijntracers.[21]
Amniota





Overzicht
Bij amniota (reptielen, vogels en zoogdieren) omvat de gastrulatie de vorming van de blastopore, een opening in de archenteron. De blastopore is geen opening naar de blastocoel, de ruimte binnen de blastula, maar een nieuwe instulping die de bestaande lagen van de blastula tegen elkaar aan duwt. De gastrulatie vindt in amniota in onderstaande volgorde plaats.
- het embryo wordt asymmetrisch,
- de primitiefstreep wordt gevormd,
- cellen van de epiblast bij de primitiefstreep ondergaan een transitie van epitheliaal naar mesenchymaal weefsel en migreren door de primitiefstreep om zo de kiembladen te vormen.[8]
Verbreking symmetrie

Ter voorbereiding op de gastrulatie moet het embryo asymmetrisch worden langs zowel de proximale-distale as als de anterior-posterior as. De proximale-distale as wordt gevormd wanneer de cellen van het embryo de "eicilinder" vormen. Die bestaat uit de extra-embryonale weefsels (EXE), die structuren zoals de placenta laten ontstaan aan het proximale uiteinde en de epiblast aan het distale uiteinde. Diverse signaaltrajecten leveren een bijdrage aan deze reorganisatie, waaronder BMP, FGF, nodal en Wnt. Visceraal endoderm omringt de epiblast. Het distale viscerale endoderm migreert naar het anterior gedeelte van het embryo en vormt het "voorste viscerale endoderm". Dit breekt de anterior-posterior symmetrie en wordt gereguleerd door nodale signalering.[8]
Bepaling van de kiemlaag
De primitiefstreep wordt gevormd aan het begin van de gastrulatie en bevindt zich dan op het kruisvlak tussen het extra-embryonale weefsel en de epiblast, aan de achterzijde van het embryo en de plaats van instulping.[22] De vorming van de primitiefstreep is in de cellen die bijdragen aan de primitiefstreep afhankelijk van nodale signalering[8] in de sikkel van de Koller en van BMP4-signalering vanuit het extra-embryonale weefsel.[22][23] Verder houden de eiwitten Cer1 en Lefty1 als antagonisten van nodale signalering de primitiefstreep op de juiste plaats.[24] De primitiefstreep blijft naar het distale uiteinde toe groeien.[8]
Tijdens de vroegste ontwikkelingsstadia is de primitiefstreep de structuur die bilaterale symmetrie bewerkstelligt, de plaats van de gastrulatie bepaalt en de vorming van de kiemlagen initieert. Om deze streep te vormen, plaatsen de embryo’s van reptielen, vogels en zoogdieren mesenchymcellen langs de toekomstige middellijn, waardoor de eerste embryonale as wordt bepaald, evenals de plaats waar cellen zullen instulpen en naartoe zullen migreren tijdens het gastrulatieproces en de daarin vervatte vorming van de kiemlagen.[25] De primitiefstreep strekt zich langs deze middellijn uit en creëert de antero-posteriore lichaamsas,[26] die daarmee de eerste symmetriebrekende gebeurtenis in het embryo wordt en het begin van de gastrulatie markeert.[27] Dit proces omvat het naar binnendringen van mesoderm- en endoderm-voorlopers en hun migratie naar hun uiteindelijke positie,[26][28] waar ze zullen differentiëren in de drie kiembladen.[25] De lokalisatie van het celadhesie- en signaalmolecuul beta-catenine is van cruciaal belang voor de juiste vorming van het ‘organisatorgebied’ dat de gastrulatie initieert.
Om de cellen van het epitheel van de epiblast door de primitiefstreep heen te laten bewegen om zo een nieuwe laag te gaan vormen, moeten de cellen bovenvermelde transitie van epitheelcellen naar mesenchymatische (EMT) ondergaan om hun epitheelkenmerken, zoals cel-celhechting, te verliezen. Voor een correcte EMT is signalering door fibroblast-groeifactoren (FGF) noodzakelijk.[29] Na de EMT stulpen de cellen via de primitiefstreep naar binnen en spreiden zich vervolgens uit om een nieuwe laag cellen te vormen of voegen zich in reeds bestaande lagen in.[24][30]
Bepaalde signalen spelen een rol bij de bestemming en de vorming van de drie kiemlagen, zoals FGF, retinezuur (RA) en Wnt.[21] Bij zoogdieren zoals muizen heeft RA-signalering invloed op longvorming. Als er onvoldoende RA aanwezig is, dan zal er een fout optreden in de vorming van het longweefsel. RA reguleert ook de ademhalingscapaciteit.
Celsignalering die gastrulatie aandrijft
Tijdens de gastrulatie worden de cellen gedifferentieerd naar het ectoderm of mesendoderm, dat zich vervolgens verdeelt in het mesoderm en het endoderm.[21] Het endoderm en het mesoderm vormen zich op instigatie van nodale signalering. Nodale signalering maakt gebruik van liganden die deel uitmaken van de tumor-groeifactorenβ (TGFβ). Deze liganden zullen transmembraan serine/threonine-kinase-receptoren signaleren, en dit zal dan Smad2 en Smad3 fosforyleren. Dit eiwit zal zich vervolgens hechten aan Smad4 en transloceren naar de celkern waar zij transcriptie van de genen die coderen voor mesendoderm zullen initiëren. Het Wnt-traject speelt samen met β-catenine een sleutelrol bij deze nodale signalering en endodermvorming.[31] Fibroblast-groeifactoren (FGF), het canonieke Wnt-traject (zie hierboven), botmorfogenetisch eiwit (BMP) en retinezuur (RA) zijn allemaal belangrijk bij de vorming en ontwikkeling van het endoderm.[21] FGF is belangrijk bij het induceren van het homeobox-gen, dat de vroege anatomische ontwikkeling reguleert. BMP-signalering speelt een rol in de lever en bevordert de bestemming van cellen tot levercellen. RA-signalering induceert ook homeobox-genen, zoals Hoxb1 en Hoxa5. Bij afwezigheid van RA-signalering zullen muizen - bijvoorbeeld - geen longen ontwikkelen.[21] RA-signalering kent ook verscheidene toepassingen in de orgaanvorming van de faryngeale bogen en de darmen.[21]


Celsignalering bij de muis
Beschrijving behorend bij de afbeelding.
Rechterkant: Pro-Nodal uitgescheiden door het extra-embryonale ectoderm (EXE) wordt omgezet in Nodal in aanwezigheid van de convertases Furin (F) en Pace4 (P). Nodal werkt in op het visceraal endoderm (lichtgroene cellen) om de expressie van pro-Nodal en de productie van Nodal te reguleren. Er wordt een terugkoppelingsysteem tot stand gebracht tussen Nodal, BMP en Wnt3, waardoor primitieve ectodermcellen (PrEct) aan de posterior zijde binnendringen via de primitiefstreep, die zich in proximaal-distale richting blijft verlengen vanaf 6,5 dag na de bevruchting (dpc). Cellen die door de primitiefstreep migreren vormen de definitieve mesoderm (ME) en endoderm (DEnd) kiembladen.
Linkerkant: Aan de voorkant van het embryo scheidt het voorste visceraal endoderm (AVE; donkergroene cellen) de Nodale antagonisten Cer1 en Lef1 en de Wnt3 antagonist Dkk1 af, waardoor de Nodal- en Wnt3-signalering wordt geremd en zo het definitieve ectodermkiemblad wordt gevormd bij dag zeven vanaf de bevruchting. BMP4 wordt uitgescheiden door het extra-embryonale ectoderm, terwijl BMP4-antagonisten, waaronder Noggin (Ngn), Chordin (Chd) en Follistatine (Fsn), worden uitgescheiden door de primitiefknoop (N), waardoor een gradiënt van BMP4 over het definitieve ectoderm ontstaat bij (B) 7,5 dag na de bevruchting en BMP4-gemedieerde SMAD-signalering in het proximale definitieve ectoderm oppervlakte-ectoderm (SE) produceert, terwijl het distale definitieve ectoderm differentieert naar neuro-ectoderm (NE) bij afwezigheid van SMAD-signalering. (C) Na de voltooiing van de gastrulatie bij ~7,5 dag na de bevruchting differentieert het definitieve mesoderm (ME) in het paraxiaal mesoderm (pME) en het laterale plaatmesoderm (lpME), de DEnd produceert de darmbuis (GT) en de NE aanleiding geeft tot de neurale buis (NT). Verdere verklaring afkortingen: EXM/En, extra-embryonaal mesoderm/endoderm; Prox, proximaal; Dist, distaal; A, anterior; P, posterior.[32]
Na voltooiing van de gastrulatie bij ~7,5 dag vanaf de bevruchting en vóór de start van de organogenese (~8,0 dag), draait het muizenembryo binnenste buiten, waarbij het definitieve ectoderm aan de buitenkant en het definitieve endoderm aan de binnenkant komt, terwijl het definitieve mesoderm de tussenlaag blijft.[33]
Gastrulatie in vitro
Er is een aantal pogingen gedaan om de processen van gastrulatie beter te leren begrijpen met behulp van in vitro technieken die parallel en complementair liepen aan studies in embryo's. Meestal gebeurde dit met 2D[34][35][36] en 3D-celkweektechnieken (embryonale organoïden)[37][38][39][40] met behulp van embryonale stamcellen (ESC's) of geïnduceerde pluripotente stamcellen (iPSC's). Deze technieken kennen voordelen, zoals het verlagen van de kosten ten opzichte van soortgelijk werk in vivo; bovendien verminderen zij het aantal in experimenten gebruikte dieren (de 3R's). Daarnaast stellen zij wetenschappers in staat om in ruimtelijk en tijdgebonden omstandigheden nauwkeurig agonisten en antagonisten toe te dienen[38][39], hetgeen in vivo technisch moeilijk uit te voeren is tijdens de gastrulatie. Voor een compleet beeld is het echter belangrijk om de bij deze gekweekte culturen gedane observaties te koppelen aan de processen zoals die in levende embryo’s plaatsvinden.
Een voorbeeld om dit te illustreren: de geleide differentiatie van muis-ESC's heeft geresulteerd in het genereren van primitiefstreep-achtige cellen, die veel van de kenmerken van epiblastcellen vertonen, die migreren via de primitiefstreep.[34] Ook kunnen menselijke ESC's die zijn gekweekt op micropatronen en zijn behandeld met BMP4, een ruimtelijk differentiatiepatroon genereren dat vergelijkbaar is met de rangschikking van de kiemlagen in het menselijk embryo.[35][36] Tot slot kunnen kleine aggregaten van muis-ESC's - embryonale organoïden of gastruloïden - met behulp van op embryonale en organoïde cellen gebaseerde 3D-technieken een aantal processen van de vroeg-embryonale ontwikkeling bij zoogdieren laten zien, zoals symmetrie-breking, polarisatie van genexpressie, gastrulatie-achtige bewegingen, axiale verlenging en het genereren van alle drie de embryonale assen (anteroposteriore, dorsoventrale en links-rechts assen).[37][38][39][41]
Evolutie
De morfogenetische bewegingen van gastrulatie zijn in hoge mate geconserveerd in een grote verscheidenheid aan organismen. Dit heeft te maken met de noodzaak de tweedimensionale kiembladen te vormen en de creatie van een derde dimensie door invouwen van de cellen.[35] De oorsprong van de gastrula kan verklaard worden met de gastraea theorie van Ernst Haeckel, die het bestaan veronderstelde van een vroege metazoan, een primitief dier, die op een gastrula leek. De totaliteit van evolutie van multicellulaire dieren is het resultaat van het veranderen van de ontwikkelingsprogramma's van het embryo.[42]
De eencellige eukaryoten hadden en hebben over het algemeen ongeveer dezelfde structuur, dus was er weinig extra nodig voor de ontwikkeling van meercelligheid. Mitose is een belangrijke fase in de celcyclus en vormt binnen de ontwikkeling van de morula en gastrula een gelegenheid voor de delende cel om het vlak van klieving te vormen en daarmee de verdeling van celcomponenten te regelen tussen de dochtercellen. Dit kan bepalend zijn voor de bestemming van de cel en haar differentiatie. Ook celadhesie en signalering tussen cellen vergen niet veel extra van een cel die toch al over een Golgi complex beschikt. Ook voor een extracellulaire matrix is er weinig meer nodig, wat betekent dat de eencellige organismen al vrij goed uitgerust zijn met functies die van pas komen in een meercellige ontwikkeling.
Bijna alle oocyten, zoogdieren uitgezonderd, hebben een duidelijke polariteit, een dierlijke en een vegetatieve pool. Ze zijn voor wat betreft de inhoud van het cytoplasma asymmetrisch. Toch ontstaan de meeste latere verschillen niet zozeer door polariteit, maar dankzij interactie tussen de cellen.[43]
Trivia
- De vaak geciteerde uitspraak van ontwikkelingsbioloog Lewis Wolpert luidt, dat "het niet de geboorte, het huwelijk of de dood is, maar de gastrulatie die werkelijk de belangrijkste tijd in je leven is".[44]
- Ernst Haeckel (1834-1919) stelde de hypothese voor van het bestaan van de Gastraea, een primitief organisme dat uitsluitend uit een holle celzak zou bestaan. Deze hypothese is nooit geaccepteerd aangezien een dergelijk organisme niet gevonden is, ook niet als fossiel.
Afbeeldingen
-
 Gastrulatie bij de mens
Gastrulatie bij de mens -
 Laat gastrulastadium met drie kiembladen van een menselijk embryo. (A) Dorsaal aanzicht van de kiemschijf, amnion verwijderd. (B) Sagittale doorsnede door het middengebied van (A). (C-G) Dwarsdoorsneden zoals aangegeven
Laat gastrulastadium met drie kiembladen van een menselijk embryo. (A) Dorsaal aanzicht van de kiemschijf, amnion verwijderd. (B) Sagittale doorsnede door het middengebied van (A). (C-G) Dwarsdoorsneden zoals aangegeven -
 Gastrulatie bij Abatus cordatus (zee-egel).
Gastrulatie bij Abatus cordatus (zee-egel). -
 Gastrulatie bij lancetvisjes, kikkers en de mens
Gastrulatie bij lancetvisjes, kikkers en de mens -
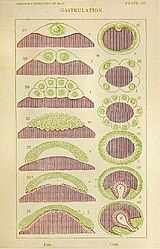 Gastrulatie bij vissen en krabben
Gastrulatie bij vissen en krabben -
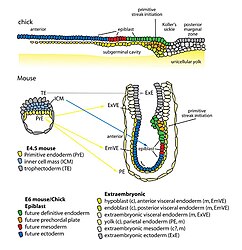 Organisatie van endodermale voorlopercellen en extra-embryonaal endoderm bij het begin van gastrulatie in kippen- en muizenembryo's
Organisatie van endodermale voorlopercellen en extra-embryonaal endoderm bij het begin van gastrulatie in kippen- en muizenembryo's -
 Experimentele manipulatie van de gastrulatie in verschillende organismen.
Experimentele manipulatie van de gastrulatie in verschillende organismen. -
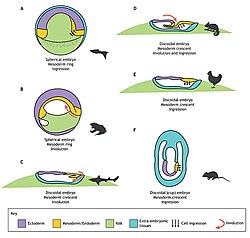 Gastrulatie bij verschillende organismen
Gastrulatie bij verschillende organismen
Onderschrift Gastrulatie bij Abatus cordatus: (A) Twee jonge gastrulae (32 dagen oud), gezien vanaf de dierlijke pool (links) en vanaf de zijkant (rechts). De perivitellineruimte is gevuld met cellen die naar de blastopore migreren en een laterale kap vormen op de helft van het oppervlak van het embryo. Pijlen geven de grenzen van de laterale kap aan. (B) 45 dagen oude gastrula omringd door het grootste aantal migrerende cellen. De diameter is ongeveer de helft van de diameter van de zona pellucida. (C) Meer ontwikkelde gastrula (60 dagen oud). Het neemt alle beschikbare ruimte binnen de zona pellucida in beslag. De zona pellucida en het embryo zijn met elkaar in contact; er is alleen een virtuele perivitellineruimte zonder migrerende cellen. Op het niveau van de blastopore aggregeren migrerende cellen tot een vitellineplug. (D) Uitkomen van de gastrula, 65 dagen na de bevruchting. A tot en met D zijn videobandframes. Afkortingen: em, embryo; fm, zona pellucida; mc, migrerende cellen; vpl, vitellineplug.
Literatuur
- Arnold, Sebastian J.; Robertson, Elizabeth J. (2009). Making a commitment: cell lineage allocation and axis patterning in the early mouse embryo. Nat. Rev. Mol. Cell Biol. 10 (2): 91–103. PMID 19129791. DOI: 10.1038/nrm2618.
- Catala, Martin (2005). Pediatric Neuroradiology: Brain. Springer, "Embryology of the Spine and Spinal Cord". ISBN 978-3-540-41077-5. Gearchiveerd op 22 april 2023.
- Ereskovsky, Alexander V. (2010). The Comparative Embryology of Sponges. Springer. ISBN 978-90-481-8574-0. Gearchiveerd op 12 mei 2023.
- Gilbert, Scott F. (2010). Developmental Biology, Ninth. Sinauer Associates. ISBN 978-0-87893-558-1.
- Hall, Brian Keith (1998). Evolutionary developmental biology, 2nd. Kluwer Academic Publishers, The Netherlands, "8.3.3 The gastrula and gastrulation". ISBN 978-0-412-78580-1. Gearchiveerd op 27 april 2023.
- Harrison, Lionel G. (2011). The Shaping of Life: The Generation of Biological Pattern. Cambridge University Press. ISBN 978-0-521-55350-6. Gearchiveerd op 27 april 2023.
- McGeady, Thomas A. (ed) (2006). Veterinary embryology. Wiley-Blackwell, "Gastrulation". ISBN 978-1-4051-1147-8. Gearchiveerd op 12 juli 2023.
- Mundlos, Stefan (2009). Vogel and Motulsky's Human Genetics: Problems and Approaches, 4th. Springer. DOI:10.1007/978-3-540-37654-5, "Gene action: developmental genetics". ISBN 978-3-540-37653-8. Gearchiveerd op 12 mei 2023.
- Tam, Patrick P.L.; Behringer, Richard R. (1997). Mouse gastrulation: the formation of a mammalian body plan. Mech. Dev. 68 (1–2): 3–25. PMID 9431800. DOI: 10.1016/S0925-4773(97)00123-8.
Websites
- YouTube. Animatie van Mary Madabhusi.
- YouTube. Animatie van Sniegouratchka.
- (en) Gastrulatieillustraties en films van Gastrulation: From Cells To Embryo; bewerkt door Claudio Stern
|





















